LA MUTATION DU GENE MDR1 (GENE DE RESISTANCE MULTIPLES AUX DROGUES) CHEZ LE CHAT
La mutation du gène, MDR1 chez le chat, et ses effets indésirables qu'elle provoque après l'administration de certains médicaments est beaucoup plus faible et moins connue que chez le chien.
5 septembre 2025.

Résumé
Cet article décrit comment la mutation du gène de multirésistance aux drogues (MDR1) chez les chats affecte la glycoprotéine P, les effets des médicaments de substrat de la glycoprotéine P sur les chats porteurs de la mutation et l'intérêt de tester les chats pour la mutation MDR1.
Points à retenir
- Il n'y a pas d'indicateurs physiques indiquant quels chats pourraient être porteurs du gène de multirésistance aux drogues (MDR1).
- La mutation MDR1 est associée à un dysfonctionnement de la glycoprotéine P, qui peut entraîner une accumulation toxique de certains médicaments et des signes neurologiques chez les chats.
- Les animaux porteurs de la mutation MDR1 sont généralement en bonne santé, à moins qu'ils ne reçoivent un médicament de substrat de la glycoprotéine P.
- Les médicaments de substrat de la glycoprotéine P connus à l'heure actuelle comprennent, sans s'y limiter, les lactones macrocycliques, certains médicaments de chimiothérapie et certains sédatifs.
- Le dépistage de la mutation MDR1 chez les chats devrait devenir une partie intégrante du dépistage des nouveaux patients et devrait être effectué avant l'administration de médicaments à base de substrat de la glycoprotéine P.
- Les chats qui présentent une réaction indésirable ont besoin d'un traitement correct qui évite d'aggraver les symptômes.
Un gène multirésistant 1 (MDR1), également connu sous le nom de sous-famille B du transporteur de cassette de liaison à l'adénosine triphosphate (ABCB1), a été découvert chez le chien en 2001 [1] et chez le chat en 2015.[2] Bien que la mutation MDR1 elle-même diffère entre les chiens et les chats, les implications cliniques sont les mêmes. Cependant, moins d'informations sont disponibles concernant la mutation chez les chats.
Appelée à l'origine sensibilité à l'ivermectine chez les colleys, la prédisposition des colleys à ressentir des réactions indésirables à l'ivermectine a conduit à la découverte de la mutation génétique.[1] Chez les chiens, la mutation MDR1 peut être retracée jusqu'à l'ascendance de la race grégaire.[3] Aujourd'hui, la mutation est encore plus répandue chez les races de bergers, telles que les colleys et les bergers australiens. Les autres races touchées comprennent les bergers allemands, les chiens de berger Shetland et les border collies.[4]
Après que la toxicité neurologique chez les chats ayant reçu de l'ivermectine ait été signalée, les chercheurs ont examiné le gène MDR1 et identifié une mutation dont la constitution génétique différait de celle des chiens. Pour les chats, cependant, l'histoire de la mutation est inconnue.
En 2022, selon l'AVMA, environ 7 % des propriétaires de chats ont acheté leur chat auprès d'un éleveur,[5] ce qui signifie que 93 % des propriétaires ont adopté leurs chats dans des refuges ou chez des amis ou les ont trouvés errants. Ainsi, comme la plupart des chats de compagnie aux États-Unis sont adoptés, il n'est pas possible de retracer leur génétique. De plus, des millions de chats sans propriétaire vivent et se reproduisent seuls, ce qui rend impossible de contrôler quels chats se reproduisent et quels gènes ils transmettent. Malgré cette incertitude, on sait que l'incidence de la mutation MDR1 est plus élevée chez les chats Maine Coon que chez les autres chats de race pure et que les chats de race mixte (c'est-à-dire les chats domestiques à poils courts, moyens et longs) sont touchés.[6] Parmi l'ensemble des chats domestiques, la mutation MDR1 est présente chez 1 % à 4 %2, ce qui signifie que 738 000 des 73,8 millions de chats aux États-Unis pourraient être porteurs de la mutation MDR1.7 À plus petite échelle, ce taux de prévalence signifie que si une clinique vétérinaire voit 100 chats par semaine, 1 ou plusieurs de ces chats sont susceptibles d'avoir la mutation MDR1 (FIGURE 1).
La mutation du gène MDR1 et l'innocuité des médicaments
La mutation génétique MDR1 perturbe la fonction de la glycoprotéine P, une protéine qui agit comme une pompe d'efflux pour éliminer les substances étrangères (par exemple, les médicaments) des cellules, en particulier des cellules endothéliales des vaisseaux sanguins et des cellules du cerveau et du foie.[8] L'absence de glycoprotéines P rend les animaux vulnérables aux effets indésirables des médicaments qui ne sont pas transportés hors des organes essentiels.
Les médicaments qui sont éliminés par la glycoprotéine P sont appelés substrats de la glycoprotéine P. Les médicaments de substrat de la glycoprotéine P utilisés chez les chats comprennent les lactones macrocycliques, les agents chimio thérapeutiques et les sédatifs. Étant donné que la mutation MDR1 affaiblit gravement la capacité de la glycoprotéine P à transporter des médicaments à partir d'organes essentiels, les substrats de la glycoprotéine P peuvent s'accumuler avec des conséquences dangereuses et peut-être mortelles. Si la glycoprotéine P ne peut pas éliminer les substrats du cerveau (à travers la barrière hémato-encéphalique et dans la circulation sanguine), leur accumulation dans le cerveau peut entraîner des signes neurologiques. Pour les patients porteurs de la mutation MDR1, les médicaments à base de substrat de la glycoprotéine P doivent être évités ou les doses doivent être modifiées.[9] Les modifications posologiques dépendent de plusieurs facteurs, notamment de l'état de santé du patient, des médicaments concomitants et du génotype MDR1 spécifique (MDR1 mutant/mutant, mutant/normal, normal/normal ; voir TERMINOLOGIE MDR1).
Conséquences de l'administration d'un substrat de la glycoprotéine P à des chats porteurs de la mutation MDR1
Certains des substrats de la glycoprotéine P les plus couramment utilisés en médecine vétérinaire sont des lactones macrocycliques.[10] Des exemples de ceux utilisés comme antiparasitaires pour les chats sont l'ivermectine, l'éprinomectine, la sélamectine, la milbémycine oxime et la moxidectine. Des rapports de toxicose à l'éprinomectine chez des chats mutants/mutants MDR1 décrivent une ataxie, des tremblements, un décubitus latéral, une mydriase et une protrusion de la langue.[11] Les chats atteints ne peuvent pas manger ou boire normalement. Si ces signes sont constatés après l'administration de lactone macrocytaire, il faut veiller à ne pas aggraver la situation. Des substrats supplémentaires de la glycoprotéine P peuvent avoir un effet cumulatif sur le système nerveux central et entraîner une aggravation des signes cliniques, le coma et éventuellement la mort. Un traitement de soutien est essentiel, et la période de récupération peut être longue et coûteuse, ce qui rend le coût du traitement prohibitif.[10] Le dépistage de la mutation du gène MDR1 avant l'administration de produits à base de lactone macrocyclique permet de contourner le risque d'effets indésirables et d'économiser de l'argent à long terme.
D'autres substrats de la glycoprotéine P comprennent des agents chimiothérapeutiques[12], qui peuvent entraîner une neutropénie, une thrombocytopénie, des vomissements et de la diarrhée chez les animaux porteurs de la mutation du gène MDR1, retardant ainsi le traitement indispensable lorsque le temps est crucial. Il est préférable de tester un chat avant le traitement et de modifier les dosages plutôt que de risquer des effets indésirables potentiellement mortels chez un patient déjà compromis.
Une grande partie de ce qui est actuellement recommandé pour l'innocuité des médicaments en ce qui concerne la glycoprotéine P provient de recherches chez les chiens porteurs de la mutation MDR1, mais il est raisonnable d'appliquer ces connaissances aux chats. Par exemple, certains sédatifs couramment utilisés chez les chiens sont les substrats de la glycoprotéine P, tels que le butorphanol et l'acépromazine.[9] Un autre substrat de la glycoprotéine P utilisé chez les chiens est le maropitant, qui est largement utilisé pour le traitement prophylactique des nausées et des vomissements. [13] Bien que ces médicaments n'aient pas été testés chez des chats porteurs de la mutation du gène MDR1, il est raisonnable de faire preuve de prudence lors de leur administration à des chats, surtout s'ils sont utilisés en conjonction avec d'autres substrats de la glycoprotéine P. Certains substrats de la glycoprotéine P ne sont pas aussi forts que d'autres, de sorte que les effets peuvent ne pas être aussi évidents, mais lorsqu'un substrat de la glycoprotéine P est combiné à un autre, les résultats peuvent être plus profonds. De manière anecdotique, certains propriétaires ont signalé que leur animal était léthargique ou semblait « éteint » ou « pas lui-même » pendant qu'il recevait du maropitant (un substrat de glycoprotéine P plus faible), mais qu'il était revenu à la normale dès que le maropitant a été arrêté.
Détection des patients porteurs de la mutation MDR1
Contrairement aux chiens, pour lesquels plus de 50 % de certaines races sont touchées, il n'y a pas de fortes prédilections pour les chats ni de moyens de prédire quels chats pourraient avoir la mutation MDR1. La seule façon de savoir si un chat a la mutation MDR1 est le test (génotypage), qui devrait être proposé dans le cadre du dépistage de la santé de chaque chat, en particulier ceux qui recevront des antiparasitaires. Un test facile, largement disponible et abordable (70 $) est disponible par l'intermédiaire du programme de médecine individualisée du Collège de médecine vétérinaire de l'Université de l'État de Washington (PrIMe ; go.navc.com/4lNbYdF) et peut être effectué par les clients à domicile (échantillon d'écouvillonnage de la joue) ou à la clinique (prélèvement de sang ou d'ADN, échantillon de brosse) avant que tout médicament potentiellement toxique ne soit administré à un chat en bonne santé.
L'absence de caractéristiques physiques associées à la mutation MDR1 chez les chats et le manque d'informations sur les étiquettes des médicaments concernant leur statut de substrat de la glycoprotéine P augmentent le risque d'effets indésirables graves des médicaments. Certains médicaments de substrat de la glycoprotéine P d'une espèce peuvent être applicables à une autre espèce, mais peuvent également différer d'une espèce à l'autre. Il est concevable que les substrats de la glycoprotéine P pour les chiens ou les humains puissent être des substrats de la glycoprotéine P pour les chats. [9]
Parmi les nouveaux médicaments continuellement développés et commercialisés pour les chiens et les chats, la plupart ne sont pas évalués pour le statut du substrat de la glycoprotéine P. Ainsi, prescrire des médicaments à des chats dont le génotype MDR1 est inconnu peut s'avérer risqué. En 2023, un nouvel antiparasitaire contenant de l'éprinomectine a été introduit sur le marché, après quoi une augmentation des effets indésirables a été observée chez les chats mutants/mutants MDR1. De nombreux jeunes chats en bonne santé ont ressenti des effets neurologiques pendant des semaines et sont décédés par la suite. Ainsi, la clé de la prévention des effets indésirables médiés par la glycoprotéine P est de déterminer le génotype des patients félins avant d'administrer des médicaments potentiellement dangereux.
Une source de médicaments problématiques pour les chats porteurs de la mutation MDR1 se trouve à go.navc.com/4lRHpDD. Cette liste n'est pas exhaustive, car de nouveaux médicaments sont testés en permanence. Quelques exemples de médicaments actuellement testés sont le cisapride, la cyclosporine A et la méthylprednisolone. La FDA recommande de déterminer l'état du substrat de la glycoprotéine P des médicaments avant qu'ils ne soient commercialisés pour une utilisation chez l'homme, mais la même exigence n'existe pas pour les médicaments destinés aux animaux.14 Les sociétés pharmaceutiques vétérinaires n'effectuent pas ces tests, mais ceux-ci sont effectués au laboratoire de pharmacologie clinique vétérinaire de l'Université de l'État de Washington et sont financés par la Fondation EveryCat Health (everycat.org). Les organisations doivent compter sur des donateurs privés ou des subventions pour soutenir les tests de substrats possibles de la glycoprotéine P chez les chats. Une fois que les résultats des tests ont été examinés par des pairs et publiés, les substrats de la glycoprotéine P sont ajoutés à la liste des médicaments problématiques sur le site Web de l'Université de l'État de Washington. On espère qu'à l'avenir, les sociétés pharmaceutiques commenceront à tester les médicaments pour déterminer le statut de la glycoprotéine P avant qu'ils ne soient autorisés à être utilisés en médecine vétérinaire. Une telle mesure préventive pourrait fournir aux professionnels vétérinaires des informations précieuses et éviter de nombreux effets indésirables chez les patients porteurs de la mutation MDR1.
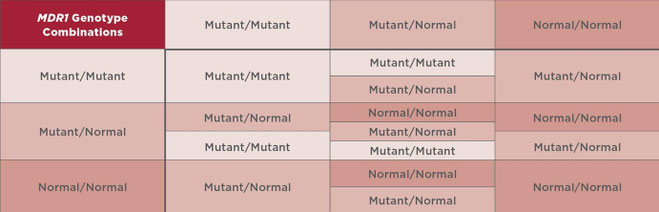
Terminologie MDR1
Un animal hérite de 2 copies du gène MDR1 1 de chaque parent, ce qui est pertinent car de nombreux clients signalent que leur chien ou chat est «positif au MDR1 », ce qui est incorrect car le gène MDR1 existe chez chaque chat et chien (FIGURE 2). C'est la mutation du gène MDR1 qui pose problème.
- Pour les animaux avec 2 copies de la mutation du gène MDR1, la terminologie préférée est « mutant/mutant MDR1 ».
- Pour les animaux avec seulement 1 copie de la mutation du gène MDR1, la terminologie préférée est « mutant MDR1/normal ».
- Pour les animaux sans mutation du gène MDR1, la terminologie préférée est « MDR1 normal/normal ».
Une table avec des noms différents. Le contenu généré par l'IA peut être incorrect.
Scénario hypothétique
Un matin, un chaton domestique à poil court domestique intact de 9 mois est emmené dans un hôpital vétérinaire d'urgence en raison d'une ventroflexion cervicale et d'un décubitus latéral. L'examen détermine en outre qu'il souffre également d'une mydriase sans réflexe palpébral et d'une protrusion de la langue. Le client affirme que le chaton a commencé à « marcher bizarrement » la nuit dernière et qu'ils l'ont trouvé dans cet état le matin. Par coïncidence, il avait été vu la veille à la clinique vétérinaire de sa région pour un examen de bien-être de chaton. C'était un chaton joueur en parfaite santé. Il a reçu sa dernière série de vaccins et une application de parasiticide lors de sa visite au cabinet. Le chaton allait bien lorsqu'il a quitté l'hôpital la veille. Son propre frère dans la même maison a reçu les mêmes traitements. Les chats ont été gardés séparés après l'application du parasiticide afin d'éviter l'ingestion orale involontaire du parasiticide topique par toilettage. Le frère ou la sœur ne présentait aucun signe clinique.
Ce scénario est une présentation classique d'un chat homozygote pour la mutation génétique MDR1 et présentant une réaction indésirable à un antiparasitaire contenant de l'éprinomectine. Il faut du temps et un traitement de soutien, en particulier l'hydratation et le soutien nutritionnel, pour aider les chats à éliminer l'éprinomectine du cerveau, mais il est tout aussi utile d'éviter les traitements médicamenteux qui exacerbent la toxicose neurologique.
Communiquer avec les clients
Expliquer la mutation génétique MDR1 et ses conséquences aux clients lors de l'examen annuel de leur chat pourrait les encourager à tester leurs chats pour la mutation génétique MDR1. Les propriétaires doivent être informés que la mutation génétique rend les chats plus sensibles aux réactions indésirables à certains médicaments, y compris certains antiparasitaires, anesthésiques, antinauséeux et agents chimio thérapeutiques. Les clients doivent également être informés qu'il n'y a pas de prédicteurs physiques, tels que la race ou la couleur du pelage, pour la mutation (FIGURE 3) et que le test est le seul moyen de déterminer le génotype MDR1 d'un chat.

Résumé
Connaître le génotype MDR1 d'un patient pourrait sauver des vies pour prévenir et traiter les réactions indésirables aux substrats de la glycoprotéine P. Malheureusement, la mutation MDR1 est souvent diagnostiquée après qu'un chat ait subi une réaction indésirable au médicament plutôt que lors du génotypage effectué avant l'administration du médicament. L'auteur est au courant de nombreuses situations dans lesquelles la mutation a été découverte trop tard et le chat est mort ou a été euthanasié en raison de la gravité de la réaction indésirable du médicament. Les chats peuvent se remettre complètement de l'insulte et l'ont fait si on leur donne le temps et une prise en charge médicale de soutien appropriée. Des tests de dépistage de la mutation du gène MDR1 devraient être ajoutés aux tests proposés aux clients afin de s'assurer que les patients ne sont pas blessés par inadvertance par des mesures conçues pour les protéger.
Références
1. Mealey KL, Bentjen SA, Gay JM, Cantor GH. Ivermectin sensitivity in collies is associated with a deletion mutation of the mdr1 gene. Pharmacogenetics. 2001;11(8):727-733. doi:10.1097/00008571-200111000-00012
2. Mealey KL, Burke NS. Identification of a nonsense mutation in feline ABCB1. J Vet Pharmacol Ther. 2015;38(5):429-433. doi:10.1111/jvp.12212
3. Connors RL. MDR1 genetic testing: what you need to know. Today’s Veterinary Nurse. September 1, 2017. Accessed December 17, 2024. https://todaysveterinarynurse.com/clinical-pathology/mdr1-genetic-testing
4. Hawkins R. Dog breeds commonly affected by MDR1 mutation. Washington State University College of Veterinary Medicine Program in Individualized Medicine. October 19, 2021. Accessed February 12, 2025. https://prime.vetmed.wsu.edu/2021/10/19/breeds-commonly-affected-by-mdr1-mutation
5. 2022 AVMA pet ownership and demographics sourcebook. American Veterinary Medical Association. May 2022. Accessed February 6, 2025. https://ebusiness.avma.org/files/ProductDownloads/eco-pet-demographic-report-22-low-res.pdf
6. Anderson H, Davison S, Lytle KM, et al. Genetic epidemiology of blood type, disease and trait variants, and genome-wide genetic diversity in over 11,000 domestic cats. PLoS Genet. 2022;18(6):e1009804. doi:10.1371/journal.pgen.10098047.
7. 2024 AVMA pet ownership and demographics sourcebook. American Veterinary Medical Association. Accessed February 6, 2025. https://ebusiness.avma.org/productcatalog/product.aspx?ID=2206
8. Staud F, Ceckova M, Micuda S, Pavek P. Expression and function of P-glycoprotein in normal tissues: effect on pharmacokinetics. In: Zhou J, ed. Multi-Drug Resistance in Cancer. Humana Press; 2010:199-222.
9. Mealey KL, Owens JG, Freeman E. Canine and feline P-glycoprotein deficiency: what we know and where we need to go. J Vet Pharmacol Ther. 2022;46(1):1-16. doi:10.1111/jvp.13102
10. Merola VM, Eubig PA. Toxicology of avermectins and milbemycins (macrocyclic lactones) and the role of P-glycoprotein in dogs and cats. Vet Clin North Am Small Anim Pract. 2018;48(6):991-1012. doi:10.1016/j.cvsm.2018.07.002
11. Mealey KL, Burke NS, Villarino, NF, Court MH, Heusser JP. Application of eprinomectin-containing parasiticides at label doses causes neurological toxicosis in cats homozygous for ABCB11930_1931del TC. J Vet Pharmacol Ther. 2024;47(3):226-230. doi:10.1111/jvp.13431
12. Mealey KL, Fidel J. P-glycoprotein mediated drug interactions in animals and humans with cancer. J Vet Intern Med. 2015;29(1):1-6. doi:10.1111/jvim.12525
13. Hawkins R. Problem medications for dogs. Washington State University College of Veterinary Medicine Program in Individualized Medicine. March 1, 2022. Accessed February 11, 2025.
https://prime.vetmed.wsu.edu/2022/03/01/problem-medications-for-dog
14. In vitro metabolism- and transporter-mediated drug-drug interaction studies guidance for industry: draft guidance. U.S. Food and Drug Administration. October 2017. Accessed May 27, 2025. https://www.fda.gov/files/drugs/published/In-Vitro-Metabolism–and-Transporter–Mediated-Drug-Drug-Interaction-Studies-Guidance-for-Industry.pdf
